Trabajo De Física De
Recuperación
Ácidos y Bases
- NOMBRE LISBETH CAROLINA DEL PEZO BRITO
- CURSO 1 Bachillerato
- LICENCIADA jhanneth parra
- ASIGNATURA Química
- AÑO LECTIVO 2016 / 2017
- ÍNDICE
1. teorías de ácidos y bases
2.ácido
hidróxidos o bases
clasificación de los ácidos y las bases
5.fuerzas de los ácidos y bases
nomenclatura delos ácidos
7. nomenclatura de las bases
8. parámetros de ácidos y bases
9 .bibliografía
- DESARROLLO DE LOS TEMAS
- TEMA ÁCIDOS Y BASES USADAS EN CASA
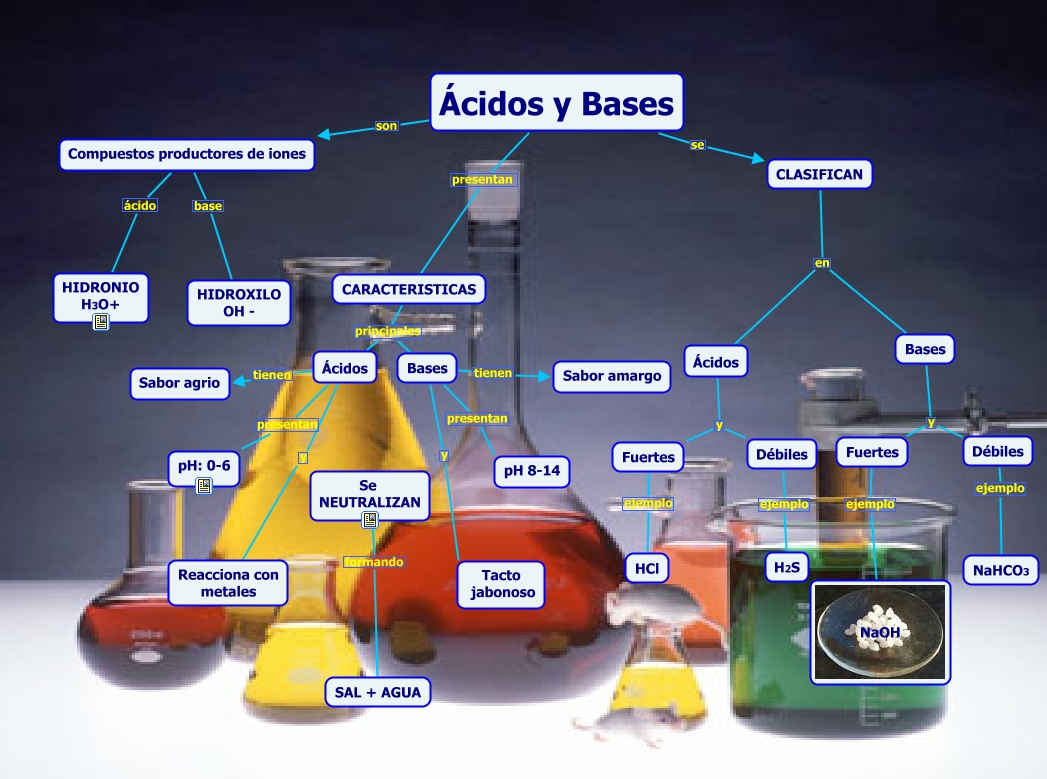
Los ácidos son moléculas que liberan iones de
hidrógeno o protones en una solución. Por lo general son agrios y pueden
disolver metales.
Las también son moléculas que son de sabor amargo y tienen opaco. Los ácidos y las bases pueden ser fuertes o débiles.
Los ácidos y las pueden ser fuertes o débiles. Cuando se combinan los ácidos y las bases en una mezcla, se neutralizan entre sí.
- ¿Que son ácidos
Un ácido (del latín acidus, que significa agrio) es considerado tradicionalmente como cualquier compuesto químico que, cuando se disuelve en agua, produce una solución con una actividad de catión hidronio mayor que el agua pura, esto es, un pH menor que 7.
Un ácido es considerado tradicionalmente como cualquier compuesto químico que, cuhidronio mayor que el agua pura, esto es, un pH menor que 7. Esto se aproxima a la ando se disuelve en agua, produce una solución con una actividad de catión definición moderna de Johannes Nicolaus Brønsted y Thomas Martin Lowry, quienes definieron independientemente un ácido como un compuesto que dona un catión hidrógeno (H+) a otro compuesto (denominado base). Algunos ejemplos comunes son el ácido acético (en el vinagre), el ácido clorhídrico (en el Salfumant y los jugos gástricos), el ácido acetilsalicílico (en la aspirina), o el ácido sulfúrico (usado enbaterías de automóvil).
Los conceptos de base y ácido son yuxtapuestos. Para medir la basicidad (o alcalinidad) de un medio acuoso se utiliza el concepto de pOH, que se complementa con el de pH, de forma tal que pH + pOH = pKw, (Kw en CNPT es igual a 10−14). Por este motivo, está generalizado el uso de pH tanto para ácidos como para bases.
La teoría ácido-base de Brønsted-Lowry, formulada por Brønsted y Lowry en 1923, dice que una base es aquella sustancia capaz de aceptar un protón (H+). Esta definición engloba la anterior: en el ejemplo anterior, el KOH al disociarse en disolución da iones OH−, que son los que actúan como base al poder aceptar un protón. Esta teoría también se puede aplicar en disolventes no acuosos.
Lewis en 1923 amplió aún más la definición de ácidos y bases, aunque esta teoría no tendría repercusión hasta años más tarde. Según la teoría de Lewis una base es aquella sustancia que puede donar un par de electrones. El ion OH−, al igual que otros iones o moléculas como el NH3, H2O, etc., tienen un par de electrones no enlazantes, por lo que son bases. Todas las bases según la teoría de Arrhenius o la de Brønsted y Lowry son a su vez bases de Lewis.
- Ejemplos de bases de Arrhenius: NaOH, KOH, Al(OH)3.
- Ejemplos de bases de Brønsted y Lowry: NH3, S2−, HS−.
- CARACTERÍSTICAS DE ÁCIDO Y BASES
Los ácidos y las bases son diversas sustancias químicas que se encuentran en la naturaleza y que el hombre ha usado a través de los siglos, llegando a fabricar algunos para su uso mediante diversos procesos químicos, estos son sustancias útiles para la vida diaria e incluso la alimentación.
Las bases o sustancias alcalinas son aquellas cuyo pH es mayor a 7, entre ellas podemos contar a los hidróxidos de sodio, hidróxidos de potasio, algunos productos de limpieza como el cloro, también llamado legía, (el ácido clorhídrico es en realidad una base, pero se le contó erróneamente entre los ácidos), el bicarbonato de sodio, la leche, la sangre, el jabón los antiácidos estomacales y el agua marina también son bases
- CLASIFICACION DE LOS ACIDOS
- 1. Los ácidos son sustancias puras que, en disolución acuosa, poseen un sabor agrio. Producen iones H+, que es constituyente especial de todos ellos. Ejm: HCl, H2SO4, H3PO4,etc. Colorean de rojo el tornasol. Son corrosivos. Reaccionan con las bases produciendo sales y reaccionan con algunos metales desprendiendo el H+. pH < 7.
- 2. Ejm: HCl (ac. MONOPROTIDOS Clorhídrico), HI (ac. Iodhídrico) Ejm: H2SO4 (ac.ACIDOS DIPROTIDOS Sulfúrico) Ejm: H3PO4 (ac. POLIPROTIDOS fosfórico)
- 3. ACIDOS FUERZA ACIDA QUIMICA BIOLOGICA FARMACOS YFUERTES DEBILES ORGANICOS INORGANICOS ORGANISMO ALIMENTOS BINARIOS O TERNARIOS U HIDRACIDOS OXIACIDOS
- 4. 1. Según su“Fuerza ácida”: ACIDO FUERTE: Aquella sustancia que se disocia (ioniza) casi totalmente en iones positivos; Ejm: H2SO4 (ac. Sulfúrico) HCl (ac. Clorhidrico) HClO4 (ac. Perclórico)
- 5. ACIDO DEBIL: Aquella sustancia que no está totalmente disociada en una solución acuosa; Ejm:H2CO3 (ac. Carbónico) H2S (ac. Sulfhídrico) HBrO (ac. Hipobromoso)
- 6. 2. Según su Química: ACIDOS ORGANICOS: Aquellas sustancias que contienen en su molécula Carbono; Ejm: CH3COOH (ac. Acético) HCOOH (ac. Fórmico) C3H7COOH (ac. Butanóico) (ác. Láctico)
- 7. ACIDOS INORGANICOS: Aquellas sustancias que carecen de Carbono. o ACIDOS BINARIOS O HIDRACIDOS: Contituidos por un no metal e Hidrógeno; Ejm: HCl (ac. Clorhídrico) HBr (ac. Bromhídrico)
- 8. o ACIDOS TERNARIOS U OXIACIDOS: Constituidos por un no metal, Oxígeno e Hidrógeno; Ejm: HClO4 (ac. Perclórico) H2SO4 (ac. Sulfúrico)
- FORMULACIÓN Y NOMENCLATURA DE LOS ÁCIDOS
OXÁCIDOS: Son compuestos ternarios, formados por la combinación de tres elementos distintos, Hidrógeno, Oxígeno y otro elemento, que por ahora llamaremos E, y que en la mayoría de los casos es no metálico . La fórmula general de los oxoácidos es: HaEbOc
REACCIÓN DE LOS OXÁCIDOS:
Anhídrido + Agua à Ácido Oxácido
Anhídrido Nitroso + Agua à Ácido Nitroso
N2O3 (g) + H2O (l) à H2N2O4 à HNO2 (ac)
Anhídrido Sulfúrico + Agua à Ácido Sulfúrico
SO3 (g) + H2O (l) à H2SO4 (ac)
En nomenclatura tradicional se puede nombrar el ácido calculando primero el números de oxidación del no metal, para ello, se debe sumar los números de oxidación de todos los elementos que forman el compuesto, multiplicados por su respectivo subíndice e igualarlos a cero, y de esta ecuación despejar el valor del número de oxidación. Ejemplo:
H2SO4 - Este es uno de los posibles ácidos del Azufre (S), si p planteo la ecuación:
2(+1)+(x)+4(-2)=0
2+x –8=0
x - 6 = 0
⇒ x= +6
El número de oxidación del S es +6. Por tanto se trata de la mayor valencia, y se establece el sufijo ..”ico” es entonces el Ácido Sulfúrico
ÓXÁCIDOS DEL GRUPO HALÓGENOS: Los halógenos que forman oxoácidos son: cloro, bromo y yodo. En los tres casos los números de oxidación pueden ser +I, +III, +V y +VII. Al tener más de dos estados de oxidación junto a las terminaciones –oso e –ico, utilizaremos los prefijos hipo– (que quiere decir menos que) y per– (que significa superior), tendremos así los siguientes oxoácidos:
HClO
|
Ácido hipocloroso (1era valencia)
|
HClO2
|
Ácido cloroso (2da valencia)
|
HClO3
|
Ácido clórico (3era valencia)
|
HClO4
|
Ácido perclórico (4ta valencia)
|
HBrO
|
Ácido hipobromoso
|
HBrO2
|
Ácido bromoso
|
HBrO3
|
Ácido brómico
|
HBrO4
|
Ácido perbrómico
|
HIO
|
Ácido hipoyodoso
|
HIO2
|
Ácido yodoso
|
HIO3
|
Ácido yódico
|
HIO4
|
Ácido periódico
|
Oxoácidos del grupo VIA
De los oxoácidos de azufre, selenio y teluro, los más representativos son aquellos en los que el número de oxidación es +IV y +VI. Para estos ácidos se utilizan los sufijos –oso e –ico.
H2SO3
|
Ácido sulfuroso
|
H2SO4
|
Ácido sulfúrico
|
H2SeO3
|
Ácido selenioso
|
H2SeO4
|
Ácido selénico
|
H2TeO3
|
Ácido teluroso
|
H2TeO4
|
Ácido telúrico
|
Oxoácidos del grupo VA
Los ácidos más comunes del nitrógeno son el ácido nitroso y el ácido nítrico en los que el nitrógeno presenta número de oxidación +III y +V, respectivamente.
HNO2
|
Ácido nitroso
|
HNO3
|
Ácido nítrico
|
Los ácidos de fósforo más comunes son el fosfónico (antes llamado fosforoso, en el que el fósforo presenta número de oxidación +III) y el fosfórico (número de oxidación +V). Ambos ácidos son en realidad ortoácidos, es decir, contienen tres moléculas de agua en su formación.
P2O3+ 3H2O à H6 P2O6 à H3PO3
|
Ácido fosfónico
|
P2O5+ 3H2O à H6 P2O8 à H3PO4
|
Ácido fosfórico
|
Oxoácidos del carbono y del silicio
El estado de oxidación, en ambos casos, es de +IV. Los más comunes son:
H2CO3
|
Ácido carbónico
|
H4SiO4
|
Ácido ortosilícico
|
COMPARACIÓN DE NOMENCLATURA QUÍMICA EN LOS ÁCIDOS
Nomenclatura tradicional
|
Nomenclatura Stock
|
Nomenclatura sistemática
| |
HNO2
|
Ácido Nitroso
|
Ácido Dioxo Nítrico (III)
|
Dioxo Nitrato (III) de Hidrógeno
|
HNO3
|
Ácido Nítrico
|
Ácido Trioxo Nítrico (V)
|
Trioxo Nitrato (V) de Hidrógeno
|
H2SO3
|
Ácido Sulfuroso
|
Ácido Trioxo Sulfúrico (IV)
|
Trioxo Sulfato (IV) de Dihidrógeno
|
H2SO4
|
Ácido Sulfúrico
|
Ácido Tetraoxo Sulfúrico (VI)
|
Tetraoxo Sulfato (VI) de Dihidrógeno
|
El ácido clorhídrico HCl que es el ácido muriático utilizado para desmanchar algunos pisos y como desinfectante.
El hidróxido de magnesio Mg(OH)₂o leche de magnesia que utilizamos como antiácido para el estómago o como laxante.
El ácido cítrico que contiene las frutas y que le da una característica especial y deliciosa a muchos alimentos.
El ácido acético CH₃- CH₂- COOH que es uno de los componentes del vinagre que utilizas, por ejemplo en alimentos.
La sosa caústica NaOH o hidróxido de calcio que utilizas para limpiar tubos y cañerias que estén un poco saturadas de cosas. =)
El ácido fólico presente en muchos alimentos (también como en los otros casos), éste si tiene una fórmula más compleja, pero se encuentra por ejemplo en las legumbres, la espinaca, algunos cereales y muchos pescados.
El hidróxido de aluminio Al(OH)₃ que también es un antiácido desde un punto de vista farmacológico.
El ácido acetil-salicílico que es el que te tomas en una aspirina, para tu dolor de cabeza por ejemplo.
El ácido butírico por ejemplo cuando se te daña una mantequilla por que la dejas al aire libre y abierta, ésta se fermenta y produce ácido butírico de sabor rancio.
El hidróxido de magnesio Mg(OH)₂o leche de magnesia que utilizamos como antiácido para el estómago o como laxante.
El ácido cítrico que contiene las frutas y que le da una característica especial y deliciosa a muchos alimentos.
El ácido acético CH₃- CH₂- COOH que es uno de los componentes del vinagre que utilizas, por ejemplo en alimentos.
La sosa caústica NaOH o hidróxido de calcio que utilizas para limpiar tubos y cañerias que estén un poco saturadas de cosas. =)
El ácido fólico presente en muchos alimentos (también como en los otros casos), éste si tiene una fórmula más compleja, pero se encuentra por ejemplo en las legumbres, la espinaca, algunos cereales y muchos pescados.
El hidróxido de aluminio Al(OH)₃ que también es un antiácido desde un punto de vista farmacológico.
El ácido acetil-salicílico que es el que te tomas en una aspirina, para tu dolor de cabeza por ejemplo.
El ácido butírico por ejemplo cuando se te daña una mantequilla por que la dejas al aire libre y abierta, ésta se fermenta y produce ácido butírico de sabor rancio.
BIBLIOGRÁFIA
- https://espanol.answers.yahoo.com/question/index?qid=20090419155111AAGPsMU
- https://www.google.com.ec/webhp?sourceid=chrome-instant&ion=1&espv=2&ie=UTF-8#q=ejemplos+de+acidos+y+bases+usados+en+la+vida+cotidiana
- https://www.google.com.ec/webhp?sourceid=chrome-instant&ion=1&espv=2&ie=UTF-8#q=FORMULACION+Y+MOMENGLATURA+DE+LOS+ACIDOS
- https://www.google.com.ec/webhp?sourceid=chrome-instant&ion=1&espv=2&ie=UTF-8#q=CLASIFICACION+DE+LOS+ACIDOS
- https://www.google.com.ec/webhp?sourceid=chrome-instant&ion=1&espv=2&ie=UTF-8#q=CARRACTERISTICA+DE+ACIDO+Y+BASE
- CONCLUSIONES
LOS ACIDOS Y BASES SIRVEN PARA COMPLETRA LAS FORMULAS TAMBIEN PARA FORMAR REACCIONES QUE SE PUEDE SACER GRACIAS ALOS COMPUESTOS QUIMICOS
GRAFICO DE ACIDOS Y BASES